快訊
- 快訊/卡達:擊落2架來自伊朗「蘇愷24」戰機 攔截7彈道飛彈
- 神盾MWC全球首發無人機低軌衛星接收器 打入西班牙電信商推進歐洲市場
- 愛立信MWC攜晶片廠卡位6G預標準 聯發科6G厘米波頻段概念機首亮相!
- 中國3名共軍上將1名前軍工高官 政協委員資格被撤
- 伊朗最高領袖身亡 建國者何梅尼之孫成接班討論焦點
- 美國防部召開記者會說明攻擊伊朗行動 「這不會變成另一場無止盡的戰爭」
- WBC》前5局僅1安!吉田正尚開轟無用 日本隊官辦熱身賽不敵歐力士
- 震撼!卡達停產天然氣 經濟部成立應變小組
- 卡達暫停生產液化天然氣 歐洲、亞洲買家將受衝擊
- 打臉中國!駐以色列代表處助2台人抵達約旦
- 快訊/對伊朗開戰後首次有美國船被打中 巴林港內美國油輪起火撤離船員
- 伊朗革命衛隊宣稱瞄準納坦雅胡總理府發射飛彈 以色列:無傷亡
- vivo「V單王」X300 Ultra 具備400mm超長焦增距鏡! 現身MWC 進軍國際
- 蔡正元有罪定讞還沒入獄!聲請再審吐苦水:被開槍險成骨灰
- 【更新】美軍3架F-15戰機遭友軍誤擊 科威特證實:飛行員成功逃生
- 伊朗頻炸鄰國 各國還不還手陷兩難、面對「不可能的選擇」
- 核三重啟進行中 台電2/13已與西屋簽約、3月底提再運轉計畫
- 質疑偵辦京華城檢察官不公 柯文哲明早赴檢評會提出個案評鑑申請
- 兒少性侵追訴權釋憲!倖存者「這簡訊」揪心 律師:痛仍希望為別人撐傘點燈
- 荷姆茲海峽封鎖影響油氣運輸 台電董座曝:5、6艘LNG船受波及
藍委質疑高端流感疫苗臨床試驗不全 食藥署:韓國數據能代表亞洲人
2023-10-18 11:09 / 作者 胡順惠

食藥署例行記者會說明高端流感疫苗臨床試驗。胡順惠攝
國民黨立委王鴻薇昨日提出質疑,高端流感疫苗臨床試驗僅針對20至50歲進行試驗,又以機密理由拒公開韓國GC公司的疫苗資料,如何讓人民相信?食藥署副署長陳惠芳今(10/18)日表示,高端有檢附韓國第一期到第三期臨床試驗,等於有亞洲人種資料,因此認為可支持其療效及安全性,無須在我國執行全年齡層臨床試驗。陳惠芳今日在例行記者會上說明,對於四價流感疫苗查驗登記,都一定要審核通過確保品質有效性才會核發許可證,臨床試驗並未限定試驗執行地點,而是視廠商所附整體臨床試驗數據結果進行審查其療效及安全性。
陳惠芳指出,依據ICH E5所訂的銜接性試驗基準審視該藥品是否具有族群差異,若經評估無族群差異者,得引用國外臨床試驗數據資料,未要求必須於我國執行臨床試驗或執行全年齡層臨床試驗,以減少重複進行臨床試驗。
陳惠芳舉例,像是跨國疫苗廠,以Covid-19疫情來說,因應疫情在不同國家原液做分裝充填,除非填充後跟原來不同,依照這樣的原則,所有疫苗案子審查都用同樣標準。
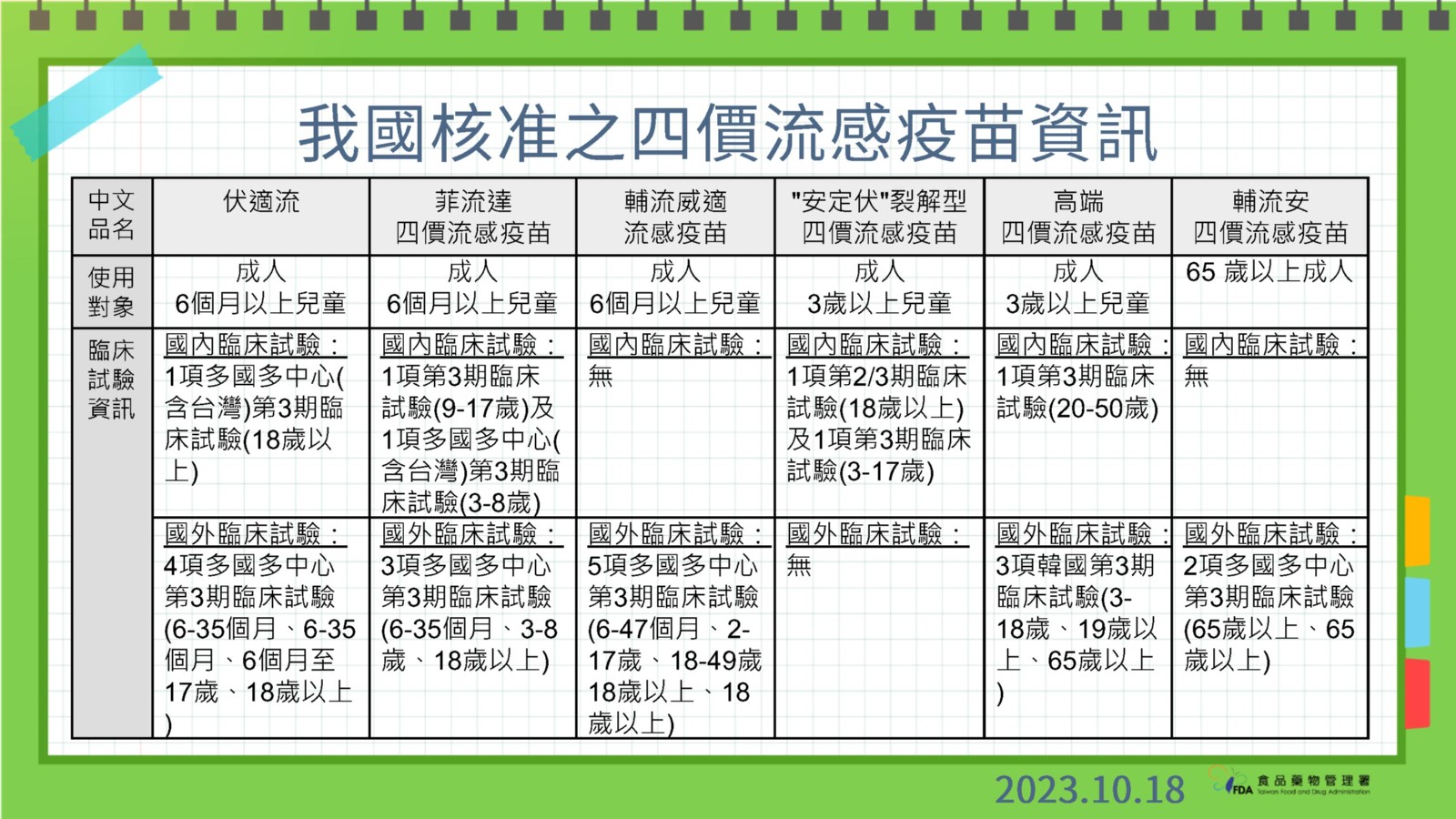
國內審核通過的6家流感疫苗資訊。食藥署提供
陳惠芳說,「高端四價流感疫苗」查驗登記案中,臨床試驗資料已檢附韓國執行的第一、第二期及第三期臨床試驗,受試者年齡包括3至18歲、19歲以上及65歲以上資料,也在我國執行第三期臨床試驗以受試者年齡:20至50歲。
因此,綜合韓國及台灣臨床試驗結果,陳惠芳指出,韓國等於有亞洲人種資料,沒有人種差異,國際上都是看人種差異,而非執行地點,因此認為可支持其療效及安全性,沒有要求全年齡層要在國內進行試驗。
至於為何不能提供臨床試驗資料?陳惠芳說依照藥事法第40-1條及營業秘密法第2條規定,藥品查驗登記時所檢附原始數據屬營業秘密資料,食藥署應保密,不過臨床試驗相關資料都有摘錄重點在仿單中,仿單可到許可證查詢系統查詢。
陳惠芳強調,所有核准的四價流感疫苗都是經由同樣標準審核,確認能達到有效性品質達一定規範才會放行,疫苗上市前一定要先檢驗、封緘才能放行供國人使用。
藥品組簡任技正黃玫甄也補充,國外數據完整情況下,可以直接引用國外數據申請許可證,只要有亞洲族群的數據就可以,不一定要做臨床試驗。
最新more>
- 快訊/卡達:擊落2架來自伊朗「蘇愷24」戰機 攔截7彈道飛彈
- 神盾MWC全球首發無人機低軌衛星接收器 打入西班牙電信商推進歐洲市場
- 九把刀揭《功夫》大改原著結局原因 入選國際影展傳捷報
- 《陽光女子合唱團》飆破7億 翁倩玉隔海謝票:不要讓我哭
- 劉冠廷100秒一鏡到底逼哭影迷 助攻《雙囍》飆破4700萬
- 「蘇打綠」睽違16年合體王菀之 方大同永遠缺席!青峰嘆:非常艱難
- 愛立信MWC攜晶片廠卡位6G預標準 聯發科6G厘米波頻段概念機首亮相!
- 健身工廠盃少年足球菁英賽圓滿落幕 U16冠軍戰加時分勝負
- 中國3名共軍上將1名前軍工高官 政協委員資格被撤
- 女孩粉注意!統一獅推週五星光女孩2.0 上半季活動名單曝光
熱門more>
- 美軍攻伊朗「南韓有意見」? 李在明:強權瓦解國際秩序、應尊重北韓體制
- 傾城酒店紅牌「3點全露」遭逮 命運捉弄!淪植物人躺13年結局曝光
- 墾丁水豚照獲國際攝影獎 台灣攝影師為「復仇」獻祭高價器材
- 伊朗自殺式無人機攻擊杜拜機場 女員工滿臉血倉皇逃命畫面曝光
- 【深度報導】同事的小孩有一半在考私校 為何連公校老師都想買「安定感」?
- 有片/楊梅重大車禍! 休旅車左轉遭大貨車猛撞「2死1命危」
- 伊朗頻炸鄰國 各國還不還手陷兩難、面對「不可能的選擇」
- 為何週六早上打伊朗?CIA超精準定位 「哈米尼9時40分在會議室」
- 悲憤喊為鮮血復仇vs.街頭跳舞喜極而泣 哈米尼之死民眾極端兩樣情
- 川普爆「德黑蘭有新領導人想談」 伊朗秒打臉:絕不談判

