- AI隱憂趨緩帶動美股收紅 台積電ADR揚升4.25%
- 巴黎羅浮宮負面消息接二連三 館長請辭獲准
- 日股戰略投資 法人點將國防軍工、商社、稀土概念股出列
- 【長榮遺產戰】開庭針鋒相對!張國煒狂轟遺囑執行人「沒做事」 這大咖喊冤挨嗆
- 台積電二千元近了! 連日漲多罕見遭列注意股 今年狂飆425元、貢獻台股3400點
- 漲到股價過熱?台積電遭證交所列注意股票 鉅額交易1筆20張均價2073.3元
- 亮刀逛大街、揚言捷運車廂內殺人 2精障男涉恐嚇公眾送醫安置6個月
- 美國貿易代表署宣布:與台灣維持已簽署的對等貿易協定
- Meta與AMD達成逾1000億美元採購協議 分散對輝達的依賴
- 法務部研議二審檢察官實任制 劍青檢改直指7大後遺症提3建議
- Anthropic讓資安巨頭市值一天蒸發百億美元 KPMG:瞄準別打錯靶
- 酷澎認了!韓國總部個資外洩影響逾20萬台灣用戶 數發部啟動行政檢查
- 紐時:經歷兩任總統、數年努力 美國依舊擺脫不了對台灣晶片的倚賴
- 【一文看懂】台美ART變廢紙? 不是這樣的! 川普B計畫仍可千錘百鍊
- 越南移工搭火車400萬現金丟了!真相扯出逾2億驚人內幕...主嫌逃了
- 川普122關稅來了!經濟部分析 情況仍比20%+N來得好
- 大華銀大華銀投信3檔債券ETF配息出爐!
- 【長榮遺產戰】6名大律師出馬!千億遺產拚換遺囑執行人 張國煒出庭3小時笑吐3字
- 破局了!賴清德國情報告協商觸礁 韓國瑜獻計無效
- 中工股價異常波動有鬼 董座赴北檢告發三大委託書通路商、律師涉犯證交法
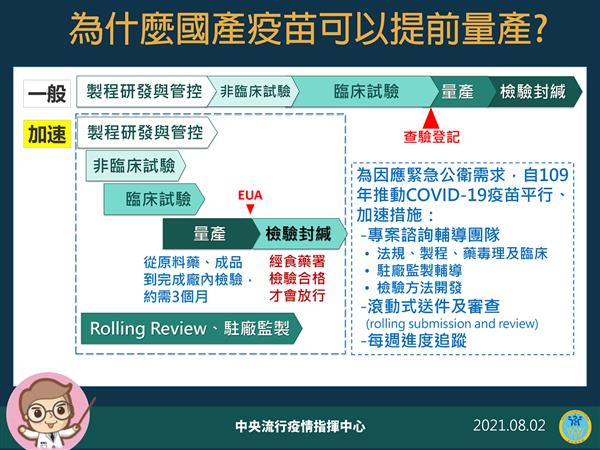
為何高端可「偷跑」量產? 陳時中:照以前方式就失去EUA意義
國產新冠肺炎疫苗高端在緊急授權(EUA)前即量產,引發爭議,懷疑有法規問題。指揮中心指揮官陳時中今(8月2日)主動說明,指出國產疫苗的生產要和疫情賽跑,如果「還停留在過去方式」,查驗登記通過後再量產,EUA就失去意義,因此在去年採購疫苗時就要求廠商先行量產。
衛福部食藥署公布,四批高端疫苗共26萬劑已完成封緘檢驗,將投入疫苗接種計畫。但疫苗封緘檢驗需30天,高端於7月18日才通過EUA,顯然在EUA審查前高端就已「偷跑」,進行封緘檢驗。
陳時中今在疫情記者會指出,一般製作流程是於研發、臨床試驗皆通過,並完成查驗登記後,廠商才會開始量產,隨後經檢驗封緘後即可上市。但為了加速疫苗研發,各國採用EUA方式簡化行政流程,若量產順序仍依過去方式,等EUA審查過後才量產,恐將耗上半年時間,這樣EUA就失去意義了。
陳時中換一種說法指出,為了加速EUA,研發時很多實驗同步進行,加速整體研發速度。一般流程依序A→B→C,ABC三個都要通過。但EUA情況下,可能每個階段做到三分之二就開始同步進行下一階段,但最後上市、注射到人體前,同樣ABC三階段都要通過才行,只是第二種作法需要投資更多錢,財務風險較高,並非每個廠商都願意這麼做。
陳時中表示,面對來勢洶洶的病毒,各國都採用事前投資的方式,我方也在預購時要求國內廠商先量產,若EUA未通過,政府就付材料費;如果過了,就可即時上市。
陳時中不斷強調,EUA「不會因已經量產了,就讓他通過」,且量產後的產品,也要逐批檢驗封緘,才能進到市場,注射到人體。
何時開始接種高端?產量達50萬劑以上
指揮中心今公布,截至今下午1點止,全國疫苗意願登記完成總人數共1204萬5564人。登記高端疫苗總計94萬8376人。高端目前完成封緘檢驗共有26萬劑疫苗,但陳時中說,以目前產量要排入預約平台尚不足。
至於要累積到多少量才能開放接種?陳時中說,有關進貨問題變數很多,無法說送上檢驗就一定會成功,但大概50至60萬劑就可開始分配讓民眾接種。
另,陳時中也透露,聯亞疫苗的EUA目前在補件中,看科學證據是否能說服專家,目前有19批已檢驗完成,若EUA完成,也能在合法合理的方式上市,會先預作準備。
- AI隱憂趨緩帶動美股收紅 台積電ADR揚升4.25%
- 巴黎羅浮宮負面消息接二連三 館長請辭獲准
- 日股戰略投資 法人點將國防軍工、商社、稀土概念股出列
- 【長榮遺產戰】開庭針鋒相對!張國煒狂轟遺囑執行人「沒做事」 這大咖喊冤挨嗆
- 「SHINee」溫流4月攻台 開賣時間藏愛的密碼
- 崔振赫為「一夜情」1周操肌5次 羞認被認真工作的女人吸引
- 「Stray Kids」瘋玩穿越闖關 秒變《魷魚遊戲》
- 台積電二千元近了! 連日漲多罕見遭列注意股 今年狂飆425元、貢獻台股3400點
- 漲到股價過熱?台積電遭證交所列注意股票 鉅額交易1筆20張均價2073.3元
- 亮刀逛大街、揚言捷運車廂內殺人 2精障男涉恐嚇公眾送醫安置6個月
- 8台星登央視春晚合唱〈寶島戀歌〉、他牽花蓮小女孩上台!伊能靜喊:中國台灣會感動
- 五楊高架驚天跳下 35歲小黃乘客暴怒令停車!翻圍籬墜地
- 開工員工還在旅遊「叫不回來」 店家急公告:228連假完才開店
- 北極熊幼崽遭格殺前最後凝視 猛虎界「黑暗騎士」入圍攝影獎
- 老高與小茉發聲了!79字曝「逃稅577萬美元遭中國拘留」現況
- 猴媽下巴多一張臉、穿山甲媽拿命換寶寶 攝影獎親子照揪感心
- 朝野跨一大步!政院版《國防特別條例》3/6付委 三黨團協商達共識
- 書包留頂樓!新北12歲女童「墜社區中庭」身亡 曾告訴爸爸這件事
- 廢墟探險!9人 「尋寶團」闖烏來溫泉飯店 全進了警局
- 【深度報導】全面出圈!台灣人瘋動漫 關鍵3因素讓宅文化大爆發